食品中的水包括結合水和自由水。食品中的結合水與蛋白質、碳水化合物等膠體物質結合在一起。在凍結過程中這部分結合水不會轉變成冰結晶,屬于不凍結水。食品中的自由水并非純水,而是溶有溶質的稀溶液,由于稀溶液中溶質的作用,造成溶液的蒸氣壓下降,使得食品開始結冰的冰點溫度比水的凍結點0℃要低(拉烏爾定律)。根據拉烏爾定律第二法則,溶液凍結點降低與溶質濃度成正比,每增加1mol/L濃度冰點下降1.86℃。
凍結點(freezing point)是指一定壓力下液態轉向固態的溫度點。低于凍結點的這一溫度被稱為過冷點,凍結點和過冷點之間的溫度差為過冷度。凍結點和過冷點之間的水處于亞穩態(過冷態),極易形成冰結晶。冰結晶的形成包括冰晶的成核和冰晶的成長過程。
一般所指的溶液或食品物料的凍結點是它們的初始凍結溫度。溶液或食品物料凍結時在初始凍結點開始凍結,隨著凍結過程的進行,水分不斷地轉化為冰結晶,凍結點也隨之降低,這樣直至所有的水分都凍結,此時溶液中的溶質、水(溶劑)達到共同固化,這一狀態點(B)被稱為低共熔點(eutectic point,cryohydric freezing point)或冰鹽凍結點。
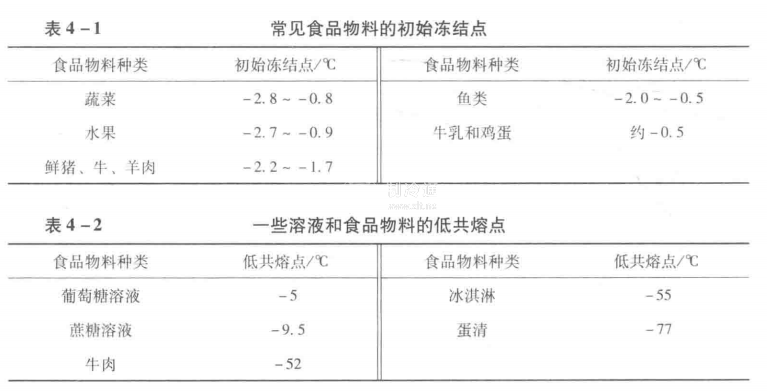
食品物料由于溶質種類和濃度上的差異,其初始凍結點會不同。即使是同一類食品物料,由于品種、種植、飼養和加工條件等的差異,也使其初始凍結點不盡相同。實際上一些食品物料的初始凍結點多表現為一個溫度范圍。表4-1列出了一些常見食品物料的初始凍結點。表4-2則列出了一些溶液和食品物料的低共熔點。